歷史沿革
衛生福利部(前身為行政院衛生署)積極進行組織變革,以保護消費者健康為核心,整併原行政院衛生署食品衛生處、藥政處、藥物食品檢驗局及管制藥品管理局等單位之職掌業務,於2010年1月1日成立「行政院衛生署食品藥物管理局」,2013年7月23日又配合行政院組織改造,改制成食品藥物管理署。成立後,從相關整體管理政策規劃到相關措施之執行過程大幅縮短且效率提升,而食品藥物資訊公開、透明迅速及多元化,讓所有消費者在食品、藥品、醫療器材及化粧品的安全品質上獲得保障。
提供服務
F棟進駐單位為藥品組及醫粧組,業務介紹如下:
藥品管理
藥品管理架構從其研發到上市,包括產品開發、臨床前試驗、臨床試驗、上市申請,及生產製造與上市等階段,皆需依循各項優良作業規範,此外,藉由法規管理國際化、生產源頭控管、上市前把關、上市後監控及藥商與產品流通管理等面向,建立藥品品質管理政策,有效控管藥品的安全、效能及品質。
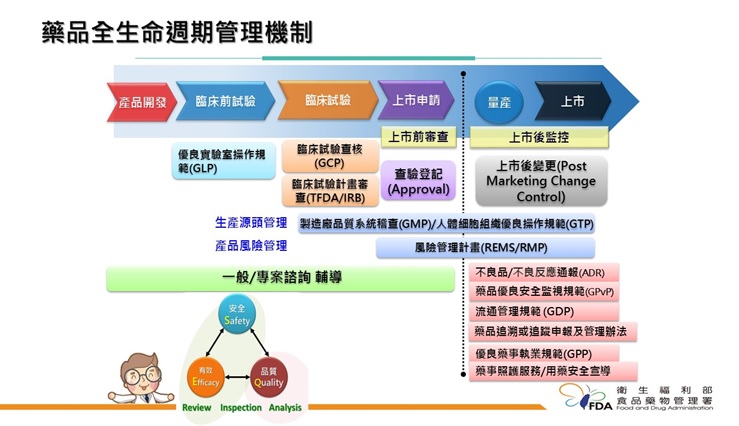
核心業務
- 藥事法及相關法規修訂、推動及國際調和
- 藥品查驗登記及諮詢輔導
- 藥品非臨床(GLP)與臨床試驗(GCP)管理
- 國內外藥廠GMP管理
- 推動實施西藥GDP
- 藥品追溯追蹤
- 藥害救濟相關
- 藥事服務管理
醫療器材管理
醫療器材管理架構,以消費者保護為核心,從產品設計、臨床前測試、臨床試驗、上市申請到上市後等階段建立相對應管理機制,藉由完整涵蓋「設計」、「製造」、「販賣」的全生命週期管理體系,有效控管醫療器材之安全、效能及品質。此外,因應國際法規趨勢,掌握環境脈動,加速建構與時俱進且與國際趨勢接軌管理政策,促進產業發展。
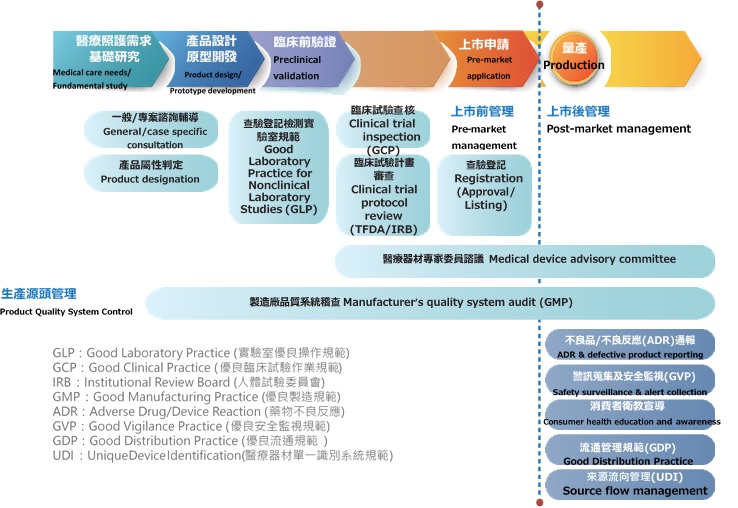
核心業務
- 醫療器材管理法修訂、推動及國際調和
- 醫療器材查驗登記與諮詢輔導
- 醫療器材國內外製造廠管理(GMP/QSD認証)
- 醫療器材法規諮詢及專案輔導機制
- 醫療器材臨床前及臨床試驗管理
- 藥商及產品追溯管理
- 醫療器材上市後安全監控及流通稽查
化粧品管理
化粧品管理架構主要分為生產源頭控管、上市前管理及上市後監督三部分。從生產源頭控管包括製造廠需符合設廠標準、化粧品優良製造準則(GMP);上市前管理為特定用途化粧品查驗登記,以及上市後執行監督產品品質,透過跨縣市聯合稽查,建立化粧品不良事件通報系統,定期監控國內外化粧品安全警訊與加強消費者安全使用宣導,以建構化粧品全方位品質安全防護網。
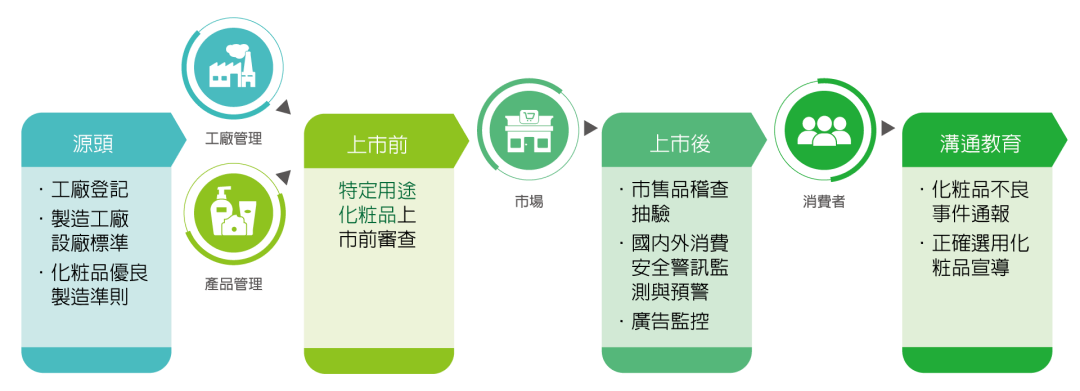
核心業務
- 化粧品管理法規修訂、推動及國際協和
- 特定用途化粧品查驗登記
- 化粧品工廠源頭管理
- 化粧品法規諮詢及輔導機制
- 化粧品上市後安全監控及流通稽查
